在医疗器械的监管体系中,第一类医疗器械因其风险程度最低,管理方式相对简化,是企业进入该领域最常见的起点。而“第一类医疗器械凭证”则是其合法上市销售的关键文件。本文将系统介绍第一类医疗器械凭证的核心概念、获取流程以及相关注意事项。
一、什么是第一类医疗器械及其凭证?
根据中国《医疗器械监督管理条例》,医疗器械按风险程度由低到高分为三类。第一类医疗器械是指风险程度低,实行常规管理足以保证其安全、有效的器械。常见的如外科用手术器械(非无菌)、听诊器、病床、基础敷料等。
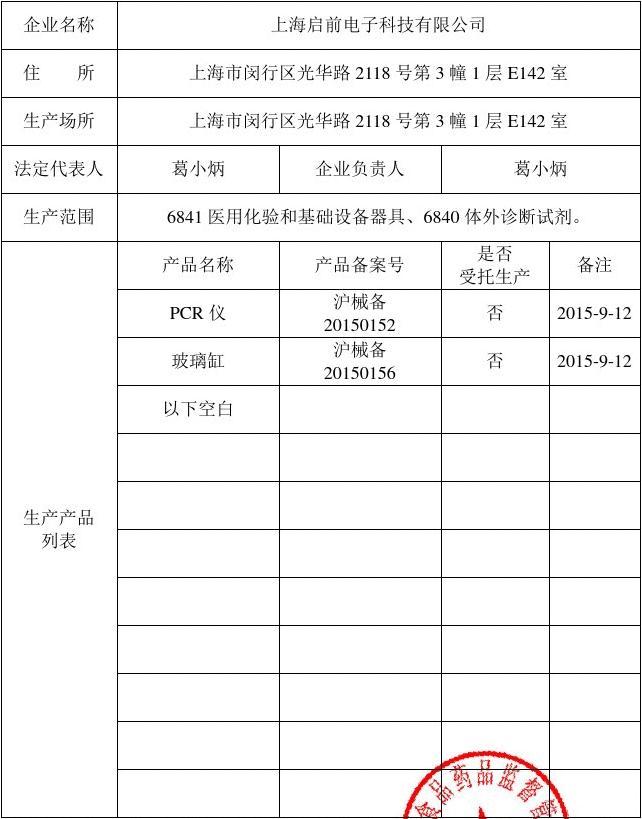
“第一类医疗器械凭证”,通常指的就是第一类医疗器械备案凭证(或备案信息表)。自2014年新版条例实施后,第一类医疗器械的生产和经营由“注册制”改为“备案制”。这意味着,符合条件的生产企业或经营企业,向所在地的市级药品监督管理部门提交备案资料后,监管部门对资料进行形式审查,符合要求的即予以备案,并发放备案凭证(一个唯一的备案编号)。这个备案编号就是该产品合法上市的首要凭证。
二、如何获取第一类医疗器械备案凭证?
获取凭证主要分为两个环节:产品备案和生产备案(或经营备案)。
1. 产品备案(产品上市许可)
- 责任主体:由医疗器械生产企业(备案人)负责。
- 备案部门:生产企业所在地的市级药品监督管理部门。
- 核心资料:主要包括备案表、产品风险分析报告、产品技术要求、产品检验报告、临床评价资料(通常为豁免临床的对比说明)、生产制造信息、产品说明书和标签样稿、符合性声明等。
- 流程:提交资料 → 监管部门审核(形式审查,通常不进行实质性技术评审)→ 符合要求,予以备案,公布备案号。
2. 生产备案(生产资质)
- 生产企业还需在开展生产活动前,向所在地的市级药监部门办理第一类医疗器械生产备案,获取《第一类医疗器械生产备案凭证》。
- 此备案关注的是企业是否具备相应的生产条件、质量管理和生产能力。
3. 经营备案(经营资质)
- 如果企业是经营第一类医疗器械,则无需办理经营许可,但需进行经营备案,获取《第一类医疗器械经营备案凭证》。
三、凭证的核心价值与注意事项
核心价值:
1. 合法性标志:备案号是产品合法生产、销售和使用的“身份证”。未备案的产品不得上市。
2. 可追溯性:备案信息向社会公开,便于监管和公众查询,保障消费者权益。
3. 管理简化:备案制相比注册制,流程更快捷,成本更低,有利于产品快速推向市场。
重要注意事项:
1. 分类准确性至关重要:企业必须严格按照《医疗器械分类目录》确定产品类别。若将本应属于第二类的产品错误地按第一类备案,将面临严重的行政处罚(如撤销备案、罚款等)。
2. 备案后监管:“备案”不等于“高枕无忧”。药监部门会加强事后监督检查,对生产条件、产品质量进行抽查。企业必须持续保证产品符合备案的技术要求。
3. 备案信息变更:若产品名称、型号规格、产品技术要求、说明书等关键信息发生变更,必须及时向原备案部门提交变更备案。
4. 跨省销售:第一类医疗器械产品备案在全国范围内有效。取得备案后,产品可以在全国销售,无需在销售地重复备案。
###
第一类医疗器械备案凭证是企业合规经营的第一步。虽然其获取流程相对简单,但企业必须深刻理解并严格遵守医疗器械法规的底线要求,确保从产品分类到生产质量管理的全链条合规。只有这样,才能借助这一“低风险”通道,安全稳健地开拓市场,为公众健康提供可靠的产品。